
매일 광고에서 볼 수 있습니다. 주름을 줄이는 크림과 로션, 흰머리를 없애는 염료, 근육통과 관절통을 줄이는 치료제. 이러한 표면 수준의 변화와 함께 나이가 들면 뇌의 염증 증가(Czirr & Wyss-Coray, 2012), 망막의 변성(Hoh Kam et al, 2010), 창자 벽(Ma et al, 1992). 노화의 징후를 되돌리는 것을 목표로 많은 산업이 구축되었습니다. 그러나 머리카락을 염색하는 것보다 더 깊은 수준에서 신체 노화의 영향을 상쇄하는 방법이 있습니까? 한 과학자 그룹은 분변 미생물 이동을 사용하여 뇌의 노화 관련 결과에 대한 시계를 되돌리는 독특한 방법을 제안합니다(FMT; Parker et al., 2022).
FMT는 병체결합 원리를 사용합니다(실제 Knowing Neurons 기사 참조). 여기에서 지금 확인해 보세요.!) 건강한 장에 사는 박테리아와 미생물 전체로 정의되는 장내 미생물 군집(Sommer et al, 2013)을 늙은 쥐와 어린 쥐 사이에서 교환합니다. FMT를 사용하여 장내 마이크로바이옴을 변경하면 뇌와 신체의 염증이 달라진다는 가설을 테스트하기 위해 Parker와 동료들은 3개월 된 마우스(어린 마우스)와 24개월된 마우스(나이 든 마우스)로 마우스 모델을 사용했습니다. ). 실험을 시작하기 전에 연구원들은 먼저 배설물을 수집하여 젊고 나이 든 마우스 미생물 군집의 기준선을 설정했습니다. 그 후 쥐의 내장에 존재하는 박테리아를 줄이기 위해 XNUMX일 동안 항생제를 투여했습니다. 항생제 치료 후 연구자들은 또 다른 배설물 샘플을 수집했습니다. 이러한 초기 단계에 이어 두 차례의 FMT를 수행하여 액체화된 대변을 비강으로 투여하고 마우스를 실험군에 따라 대변이 들어 있는 우리에 넣었습니다. 본 연구의 실험군은 어린 쥐로부터 FMT를 받은 나이든 쥐와 늙은 쥐로부터 FMT를 받은 어린 쥐였으며, 대조군은 다른 어린 쥐나 비분변 대조액(젊은 대조군 쥐라고 함)로부터 FMT를 받은 어린 쥐와 다른 노화된 마우스 또는 비분변 제어 용액(노화 제어 마우스라고 함)로부터 FMT를 받는 노화된 마우스. FMT 후, 대변은 XNUMX일 및 XNUMX주 후에 수집되었습니다. 이 실험 설계를 통해 연구자들은 장내 미생물군집의 나이가 뇌, 망막 및 장의 과정에 어떤 영향을 미치는지 연구할 수 있었습니다.
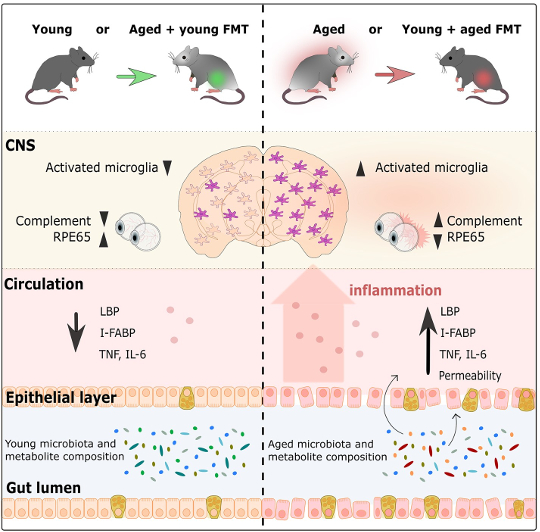
Parker et al.의 그래픽 초록, 2022
...나이 든 쥐에게 젊은 미생물 군집을 주입하면 나이가 들어감에 따라 나타나는 면역 반응이 취소됩니다.
연구자들은 먼저 FMT가 피질과 뇌량(뇌의 양쪽이 서로 통신할 수 있도록 하는 거대한 뉴런 다발)에서 뇌의 상주 면역 세포인 미세아교세포의 염증 반응에 어떤 영향을 미치는지 조사했습니다(Heneka et al, 2019 ; 어니 외, 2015). 노화된 대조군 마우스는 젊은 대조군 마우스보다 활성화된 미세아교세포를 가졌고, 이는 정상적인 노화 과정을 반영합니다. 그러나 젊은 미생물 군집을 가진 나이든 쥐는 나이 든 대조군 쥐보다 미세아교세포 활성화가 훨씬 적었습니다. 놀랍게도, 미세아교세포 반응은 어린 대조군 마우스에서 관찰된 것과 매우 유사했습니다. 이와 동일한 패턴은 반대 방향으로도 나타났는데, 이는 나이 든 미생물 군집을 가진 어린 쥐가 젊은 대조군 쥐보다 훨씬 더 많은 미세아교세포 활성화를 보였고, 대신 노화된 대조군 쥐에서 보이는 활성화 수준과 유사했습니다. 이것은 마이크로바이옴의 나이가 뇌의 면역 반응에 영향을 미치고, 늙은 쥐에게 젊은 마이크로바이옴을 주입하면 나이가 들면서 보이는 면역 반응이 취소된다는 것을 보여줍니다. 유사하게, 어린 쥐에게 노화된 마이크로바이옴을 제공하면 뇌의 면역 세포에 대한 노화의 영향이 가속화됩니다.
...미생물은 망막의 노화 관련 과정에 영향을 미칩니다...
연구원들은 뇌를 검사하는 것 외에도 장내 미생물 군집의 나이가 망막에 어떤 영향을 미치는지 조사했습니다. 일반적으로 젊은 쥐에 비해 늙은 쥐는 망막의 염증이 증가한 것으로 나타났습니다. 그러나 FMT 후, 젊은 미생물 군집을 가진 나이든 쥐는 어린 대조군 쥐와 유사한 망막 염증 수준을 보였습니다. 뇌의 발견과 일치하여 그 반대도 사실이었습니다. 노화된 마이크로바이옴을 가진 젊은 쥐는 노화된 대조군 쥐와 유사한 망막 염증이 있었습니다. 장내 마이크로바이옴은 또한 시각 시스템의 다른 부분에 영향을 미칩니다. RPE65 단백질의 도움으로 망막에서 재생하는 광수용체의 능력은 나이가 들면서 감소하는 것으로 알려져 있습니다(Cai et al, 2009). 젊은 마이크로바이옴을 가진 나이든 쥐에서는 나이 든 대조군 쥐에 비해 RPE65 단백질의 양이 증가했습니다. 사실, 이러한 단백질 수준은 어린 쥐의 수준과 비슷했습니다. 또한, 노화된 미생물 군집을 가진 젊은 쥐는 젊은 대조군 쥐보다 RPE65가 훨씬 적었으며, 단백질 수준은 노화된 쥐에서 볼 수 있는 수준과 비슷했습니다. 전반적으로 이것은 젊은 미생물군이 역전되고 노화된 미생물군이 노화와 관련된 과정을 가속화하면서 미생물군집이 망막의 노화 관련 과정에 영향을 미친다는 것을 보여줍니다.
또 다른 중요한 기관인 장도 노화의 영향을 받지 않습니다. 장의 벽을 형성하는 세포층은 시간이 지남에 따라 누출됩니다(Cui et al, 2019; Thevaranjan et al, 2017). 노화 과정에 따라 장 벽의 안정성이 감소하고 투과성이 높아져 박테리아가 주변으로 누출되어 전반적인 염증이 증가합니다(Cui et al, 2019; Thevaranjan et al, 2017). 이 연구에서 연구자들은 마이크로바이옴의 나이가 장벽의 안정성에 영향을 미친다는 것을 보여주었습니다. 젊은 미생물 군집을 가진 나이든 쥐의 경우 장에서 새는 정도가 나이든 대조군 쥐보다 적었습니다. 사실, 젊은 미생물군집을 가진 나이든 쥐의 장 투과성은 어린 쥐에서 볼 수 있는 투과성과 유사했습니다. 젊은 미생물 군집을 가진 나이든 쥐도 어린 쥐와 비슷한 수준의 염증과 혈액 내 박테리아의 증거를 보였습니다. 다시 한 번, 노화된 마이크로바이옴을 가진 젊은 쥐의 장은 젊은 마이크로바이옴을 가진 젊은 쥐보다 더 많은 장 누수와 더 많은 염증을 가짐으로써 노화된 미생물군을 가진 늙은 쥐와 유사하게 행동했습니다. 이러한 결과는 노화된 마이크로바이옴이 장 투과성 증가에 기여하여 박테리아가 혈류로 누출되도록 함으로써 염증 증가를 촉진한다는 가설을 뒷받침합니다. 중요한 것은 FMT를 통해 젊은 마이크로바이옴을 도입하면 이러한 연령 관련 효과가 역전된다는 것입니다.
…장내 미생물군의 나이는 뇌, 망막 및 장의 기능에 영향을 미칩니다.
이 연구의 결과는 장내 미생물군의 나이가 뇌, 망막 및 장의 기능에 영향을 미친다는 것을 보여줍니다. 그러나 젊고 오래된 마이크로바이옴은 서로 어떻게 다릅니까? 이 질문에 답하기 위해 연구원들은 실험 과정에서 수집된 대변 샘플에서 발견된 미생물의 DNA를 시퀀싱했습니다. 젊은이와 노인 마이크로바이옴은 FMT가 발생하기 전에 이미 다른 유전적 구성을 가지고 있었지만 FMT는 두 마이크로바이옴의 유전적 구성을 크게 변경했습니다. 노화된 마이크로바이옴을 가진 젊은 쥐는 노화된 대조군 쥐와 매우 유사한 구성을 가진 반면, 젊은 미생물군을 가진 노화된 쥐의 유전적 구성은 노화된 대조군 쥐와 다르며 젊은 미생물을 가진 젊은 쥐와도 달랐습니다. 나이 든 대조군 쥐와 나이 든 마이크로바이옴을 가진 어린 쥐는 주로 오실리박터 과 Prevotella 속, Firmicutes 문, 그리고 락토 바실루스 존슨니 반면 어린 대조군 쥐와 젊은 미생물 군집을 가진 나이든 쥐는 주로 비피, 아커만시아, 파라박테로이데스, 클로스 트리 디움및 장구균 여러 떼. 이러한 연령 관련 변화의 잠재적인 원인을 조사할 때 연구자들은 지질과 비타민 생산(박테리아에 의해 생성된 대사 산물에 의존함)과 관련된 경로가 노인과 젊은 미생물 사이에서 다르다는 것을 발견했습니다. 이 관찰에는 한 가지 단점이 있습니다. FMT XNUMX주 후 미생물군집 구성 사이에 큰 차이가 없었기 때문에 다양한 종류의 박테리아의 풍부함과 장에서의 잠재적 기능의 변화가 오래 지속되지 않았습니다.
전반적으로, 이 연구는 장내 마이크로바이옴이 뇌, 눈, 장에서 노화와 관련된 과정에 영향을 미친다는 것을 보여주었습니다. 수용 마우스의 나이와 관계없이 노화된 미생물군은 뇌, 망막 및 내장에 더 많은 염증을 일으키고 망막의 광수용체에서 재생 가능성이 적고 장에서 더 많은 박테리아가 누출되었습니다. 반면에 나이 든 쥐에게 젊은 미생물 군집을 도입하면 이러한 노화 효과가 역전되었습니다. 이것은 노인과 젊은 미생물 군집의 박테리아 구성의 차이와 이러한 변화가 지질과 비타민 생산을 담당하는 경로에 미칠 수 있는 영향 때문일 수 있습니다. 이 연구에서 다루지 않은 한 가지 질문은 대조군 마우스와 FMT 마우스가 행동 기억 테스트에서 다르게 행동했기 때문에 마이크로바이옴의 나이가 인지 성능에 어떻게 영향을 미치는가였습니다. 인지와 기억력이 나이가 들면서 감소하는 것으로 알려져 있기 때문에 향후 연구는 이 질문에 초점을 맞춰야 하며, 노화와 관련된 인지 저하에서 마이크로바이옴의 역할을 이해하면 가능한 생물학적 토대에 대한 중요한 통찰력을 제공할 수 있습니다. 향후 연구 질문이 추구해야 할 또 다른 방향은 식단이 장내 마이크로바이옴의 구성에 미치는 영향입니다. 이전 연구에서는 서로 다른 식단이 단기(David et al., 2014) 및 장기적(Wu et al., 2011) 모두에서 장내 미생물의 유형을 변화시키는 것으로 나타났습니다. 식단의 변화가 장내 마이크로바이옴의 구성을 바꿀 수 있다면 뇌, 망막, 장에서도 이러한 노화 징후를 줄일 수 있다면 어떨까요?
식단의 변화가 장내 마이크로바이옴의 구성을 바꿀 수 있다면 뇌, 망막, 장에서도 이러한 노화 징후를 줄일 수 있다면 어떨까요?
저자 정보
Written by 홀리 코타스, 삽화가 페데리카 라구세오, 편집자 요한나 포프, 사라 웨이드및 로렌 바그너
참고자료
Cai, X., Conley, SM, & Naash, MI(2009). RPE65: 시각 주기, 인간 망막 질환 및 유전자 요법에서의 역할. 안과 유전학, 30(2), 57-62. https://doi.org/10.1080/13816810802626399
Cui, H., Tang, D., Garside, GB, Zeng, T., Wang, Y., Tao, Z., Zhang, L., & Tao, S. (2019). Wnt 신호는 장 줄기 세포의 노화 유발 분화 장애를 중재합니다. 줄기 세포 검토 및 보고서, 15(3), 448-455. https://doi.org/10.1007/s12015-019-09880-9
Czirr, E., & Wyss-Coray, T. (2012). 신경변성의 면역학. 임상 조사 저널, 122(4), 1156-1163. https://doi.org/10.1172/JCI58656
데이비드, L., 모리스, C., 카모디, R. et al. 다이어트는 인간의 장내 미생물 군집을 빠르고 재현 가능하게 변경합니다. 자연 505, 559-563 (2014). https://doi-org.proxy.library.georgetown.edu/10.1038/nature12820
어니, D., 흐랍? de Angelis, AL, Jaitin, D., Wieghofer, P., Staszewski, O., David, E., Keren-Shaul, H., Mahlakoiv, T., Jakobshagen, K., Buch, T., Schwierzeck, V ., Utermöhlen, O., Chun, E., Garrett, WS, McCoy, KD, Diefenbach, A., Staeheli, P., Stecher, B., Amit, I., & Prinz, M. (2015). 숙주 미생물총은 CNS에서 소교세포의 성숙과 기능을 지속적으로 제어합니다. 자연 신경 과학, 18(7), 965-977. https://doi.org/10.1038/nn.4030
헤네카 MT(2019). Microglia는 신경 퇴행성 질환의 중심 단계를 차지합니다. 자연 리뷰. 면역학, 19(2), 79-80. https://doi.org/10.1038/s41577-018-0112-5
Hoh Kam, J., Lenassi, E., & Jeffery, G. (2010). 노화된 눈 보기: 노화된 마우스 망막의 다양한 아밀로이드 베타 축적 부위와 대식세포의 상향 조절. PloS 하나, 5(10), e13127. https://doi.org/10.1371/journal.pone.0013127
Ma, TY, Hollander, D., Dadufalza, V., & Krugliak, P. (1992). 노화 및 칼로리 제한이 장 투과성에 미치는 영향. 실험 노인학, 27(3), 321-333. https://doi.org/10.1016/0531-5565(92)90059-9
Parker, A., Romano, S., Ansorge, R., Aboelnour, A., Le Gall, G., Savva, GM, Pontifex, MG, Telatin, A., Baker, D., Jones, E., Vauzour , D., Rudder, S., Blackshaw, LA, Jeffery, G., & Carding, SR (2022). 어린 쥐와 늙은 쥐 사이의 분변 미생물 이동은 노화된 장, 눈, 뇌의 특징을 역전시킵니다. Microbiome, 10(1), 68.
https://doi.org/10.1186/s40168-022-01243-w
Sommer, F., & Bäckhed, F. (2013). 장내 미생물군—숙주 발생 및 생리학의 대가. 자연 리뷰. 미생물학, 11(4), 227-238. https://doi.org/10.1038/nrmicro2974
Thevaranjan, N., Puchta, A., Schulz, C., Naidoo, A., Szamosi, JC, Verschoor, CP, Loukov, D., Schenck, LP, 심사위원단, J., Foley, KP, Schertzer, JD, Larché, MJ, Davidson, DJ, Verdú, EF, Surette, MG 및 Bowdish, DME(2017). 연령 관련 미생물 Dysbiosis는 장 투과성, 전신 염증 및 대 식세포 기능 장애를 촉진합니다. 세포 숙주 및 미생물, 21(4), 455-466.e4. https://doi.org/10.1016/j.chom.2017.03.002
Wu, GD, Chen, J., Hoffmann, C., Bittinger, K., Chen, YY, Keilbaugh, SA, Bewtra, M., Knights, D., Walters, WA, Knight, R., Sinha, R. , Gilroy, E., Gupta, K., Baldassano, R., Nessel, L., Li, H., Bushman, FD, & Lewis, JD (2011). 장기 식이 패턴과 장내 미생물 장형을 연결합니다. 과학 (뉴욕, NY), 334(6052), 105-108. https://doi-org.proxy.library.georgetown.edu/10.1126/science.1208344
이 문서는 원래의 등장 뉴런을 아는 것






















